GMP
식품의약품안전처로부터 의료기기 품질관리 심사기관으로 지정 받아 의료기기 전 품목군(26개)에 대한
의료기기 제조 및 수입업체의 품질관리를 위한 인증평가 (GMP 마크) 업무를 수행하고 있습니다.
품질관리 심사 대상
- 의료기기를 제조 또는 수입하는 경우
- 임상시험용 의료기기를 제조하는 경우
품질관리 심사 대상
- 최초심사
- 제조 또는 수입 의료기기가 이 기준에 적합함을 인정받기
위해 최초로 받아야 하는 심사
- 정기심사
- 최초심사 후 3년 주기로 실시하는 사후 관리 심사
(유효기간 만료일 3개월 전까지 이전에 신청하여야 함.)
- 추가심사
- 별표 3에 따른 다른 품목군의 의료기기를 추가하는 경우
새로이 받아야 하는 심사
- 지원내용
- 제조소의 소재지 변경에 따라 적합성평가를 새로이 받아야
하는 심사. 다만, 제품의 품질과 관계가 적은 보관소,
시험실의 변경은 제외
업무절차
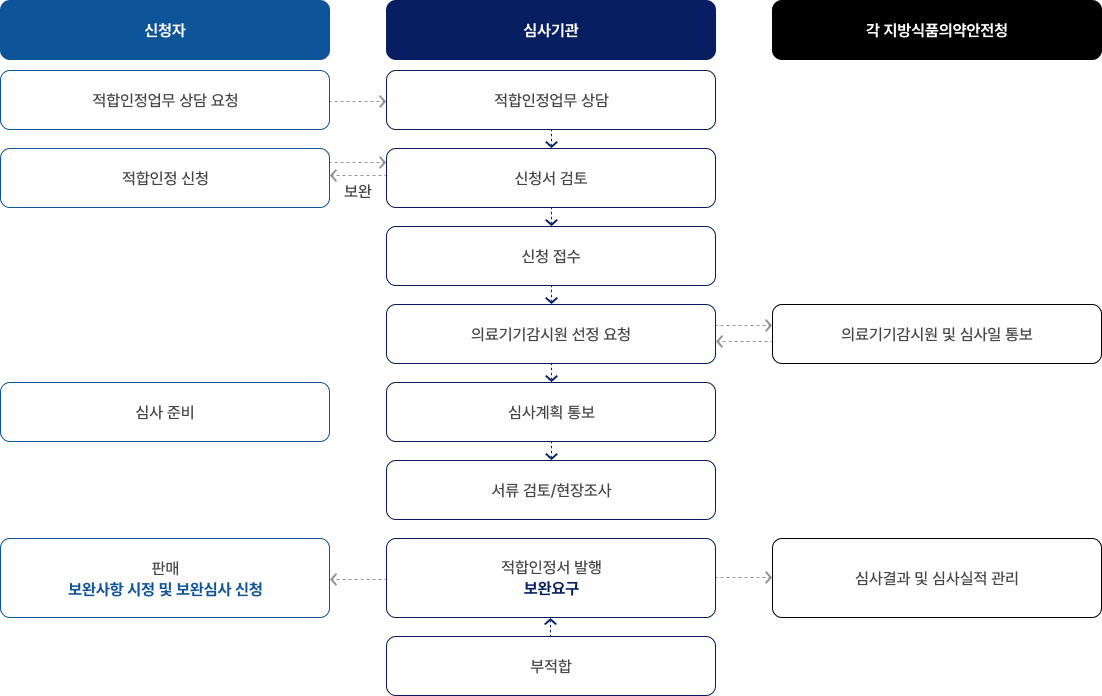


업무절차 : 신청자가 심사기관에 적합인정업무 상담 요청 > 심사기관에서 적합인정업무 상담 > 신청서 검토 > 보완 필요시 보완서류 요청 및 보완조치 > 적합인정 신청 > 신청 접수 > 심사기관에서 각 지방 식품의약안전청에 의료기기 감시원 선정요청 > 식품의약안정청에서 심사기관에 의료기기 감시원 및 심사일 통보 > 심사기관에서 신청인에게 심사계획 통보 > 신청인은 심사 준비 > 심사준비 완료 후 서류 검토 및 현장조사 실시 > 부적합시 보완요구 > 신청인이 보완사항 시정 및 보완심사 신청 > 적합시 각 지방식품의약품안전청에 적합인정서 발행 > 식품의약품안정청에서 심사결과 및 심사실적 관리, 신청인은 적합인정서 판매
